El problema típico con las partículas es el potencial de dispersión durante el período de curación inicial. Aunque pueden rehidratarse o humedecerse con varios líquidos, como solución salina, agua o un anestésico, estos líquidos no mantienen unidas las partículas y les permiten extenderse en el área durante la curación. Esto puede conducir a un menor volumen de injerto curado en el sitio deseado y puede comprometer los resultados previstos. La utilización de concentrados de sangre autógena derivados del paciente mezclados con el material de injerto en partículas mejora el manejo del injerto durante la colocación, así como contenerse en el sitio previsto lo cual elimina el potencial de dispersión. Los concentrados de sangre autóloga se definen como la porción concentrada de la sangre de los pacientes después de la centrifugación que contiene factores de crecimiento, plaquetas, leucocitos y fibrina, pero no contiene la porción de eritrocitos de la sangre.
Beneficios del uso de concentrados de sangre autógena con materiales de injerto óseo
En la década de 1980, se publicaron varios estudios que identificaron el papel fundamental que desempeña el oxígeno en la cicatrización de heridas.1-5 Estos estudios fueron los primeros en reconocer que los factores de crecimiento promueven la curación relacionada con la respuesta de los macrófagos a los gradientes de oxígeno, que secretaron esos factores de crecimiento de cicatrización de heridas. El factor de cicatrización de heridas derivado de plaquetas (PDWHF, por sus siglas en inglés) se introdujo clínicamente por primera vez,6 precediendo al plasma rico en plaquetas (PRP), utilizado durante más de 20 años para iniciar la cicatrización de heridas. Las plaquetas liberadas de trombina producen angiogénesis y síntesis de colágeno con fibrina provocando un exudado celular, seguido de angiogénesis. A principios de la década de 1990, Marx y Garg comenzaron a trabajar en el uso de sangre derivada del paciente como fuente de fibrina para utilizarla con injertos óseos para mejorar el manejo del producto. El uso de este adhesivo de fibrina se publicó por primera vez en 1994.7
Las plaquetas secretan factores de crecimiento (PDGFaa, PDGFbb y PDGFab), que estimulan la reproducción de las células madre mesenquimales, la producción de osteoblastos y matriz osteoide, así como de células endoteliales para reproducir la lámina basal secretora para nuevos vasos sanguíneos y fibroblastos para replicar la producción de colágeno. Además, los factores de crecimiento transformantes (TGFß1 y TGFß2) y la proteína morfogénica ósea (BMP, por sus siglas en inglés) están presentes y estimulan la producción de matriz y guían la diferenciación celular en el hueso. Otros factores presentes en los concentrados sanguíneos autólogos incluyen el factor de crecimiento endotelial vascular (VEGF, por sus siglas en inglés), que apoya el desarrollo de nuevos vasos sanguíneos, y el factor de crecimiento epitelial (EGF, por sus siglas en inglés), que estimula la migración del tejido blando circundante para cubrir el área y formar una membrana basal.
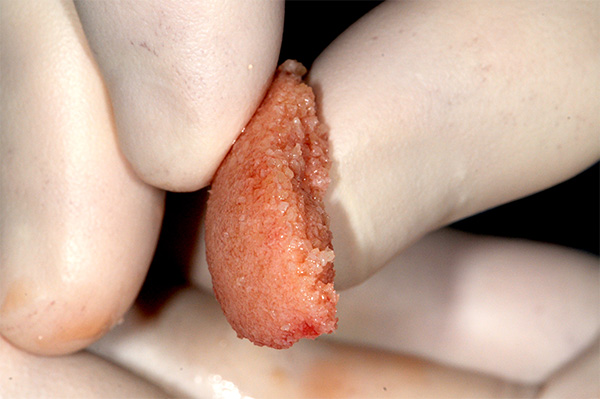
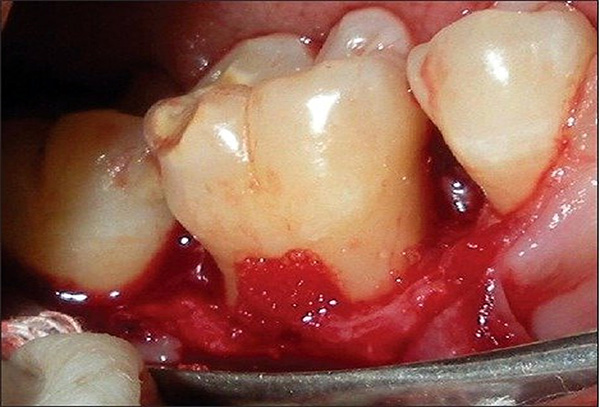
La incorporación de concentrados sanguíneos autólogos, tales como PRP en un material de injerto en partículas, proporciona factores de crecimiento para acelerar la curación del injerto, estimulando las células huésped adyacentes al injerto para convertirlas en hueso nativo. Se puede esperar un cierre más rápido del tejido blando, utilizando los factores propios del paciente como ese mecanismo estimulante. El beneficio adicional es una masa gelatinosa, denominada hueso gomoso o hueso pegajoso, que ha mejorado el manejo sin los problemas de dispersión encontrados con las partículas de injerto mezcladas con solución salina o incluso permite absorber sangre en el sitio (Figura 1). El hueso gomoso tiene una consistencia flexible similar a una masilla que se puede cortar a las dimensiones deseadas antes de la colocación y utilizarse en una variedad de situaciones clínicas de injerto que incluyen:
- Injerto alveolar (Figura 2).
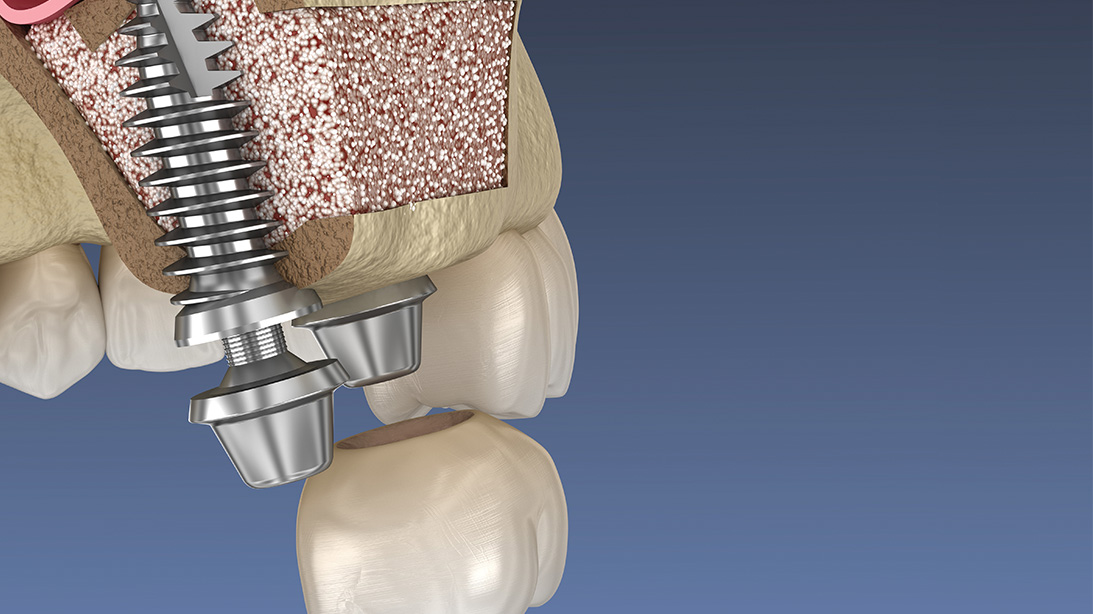
- Relleno alrededor de la colocación inmediata del implante (Figura 3).
- Aumento lateral del seno (Figura 4).
- Aumento vertical de la cresta sinusal (Figura 5).
- Expansión de la cresta lateral (Figura 6).
- Reparación de la dehiscencia en la colocación del implante (Figura 7).
- Reparación de la furca (Figura 8).
- Relleno de defectos en la cara lateral de la cresta (Figura 9).
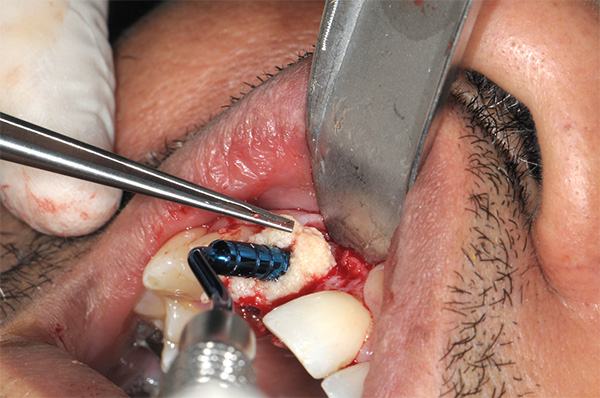
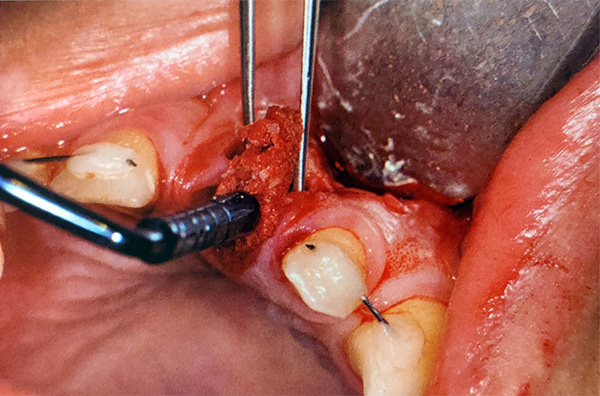
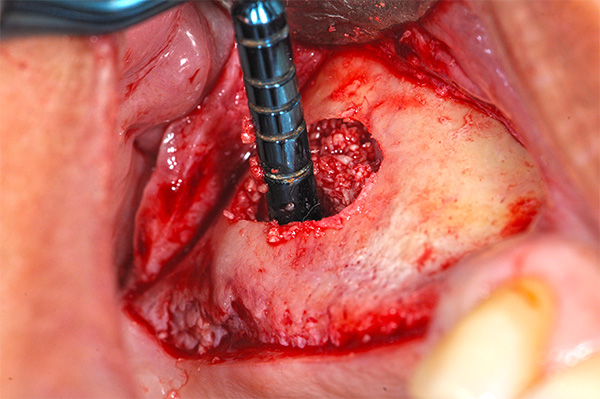
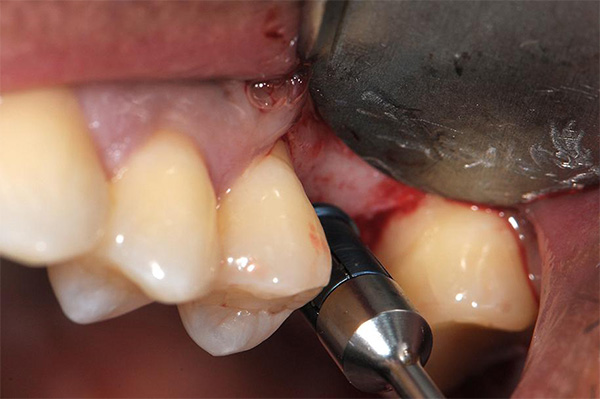
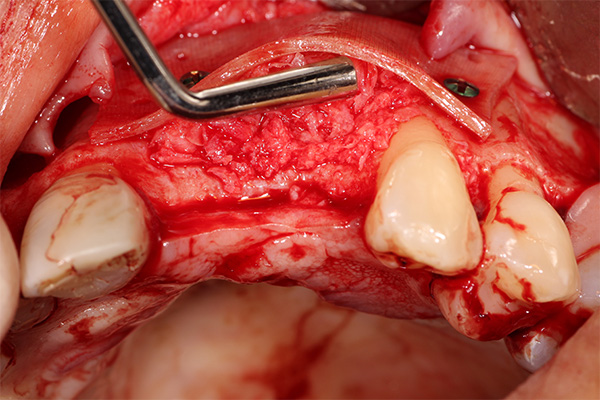
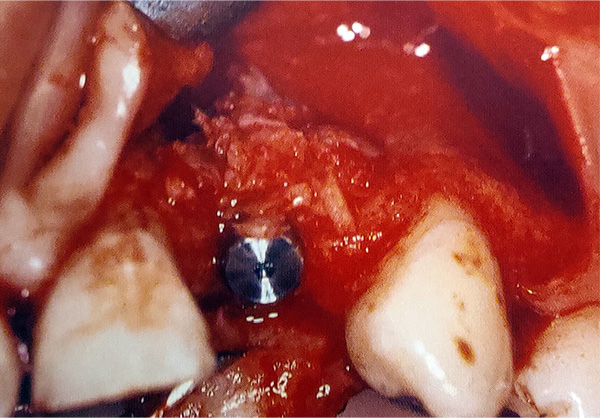
Fabricación de hueso gomoso
Al inicio del tratamiento quirúrgico, se extrae sangre del paciente a los tubos de tapa roja. Los tubos de tapa roja tienen paredes de vidrio y no contienen anticoagulantes. Estos se centrifugan inmediatamente a 3200 rpm durante 3 minutos (aproximadamente 600 fg) para crear una separación de las capas de sangre del paciente (Figura 10). Una vez completada la centrifugación, se evidencian distintas capas presentes en el tubo (Figura 11). La capa amarilla, que es el plasma con alto contenido de fibrina y plaquetas, se usará para crear hueso gomoso.


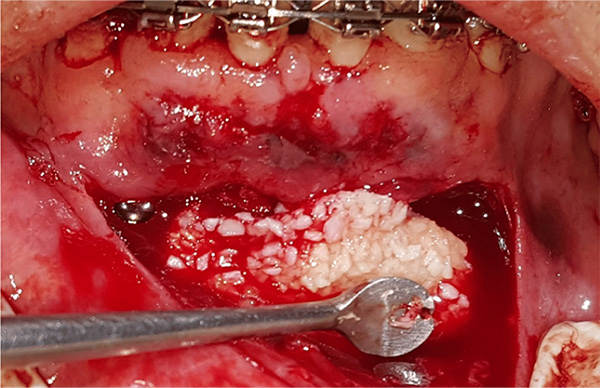
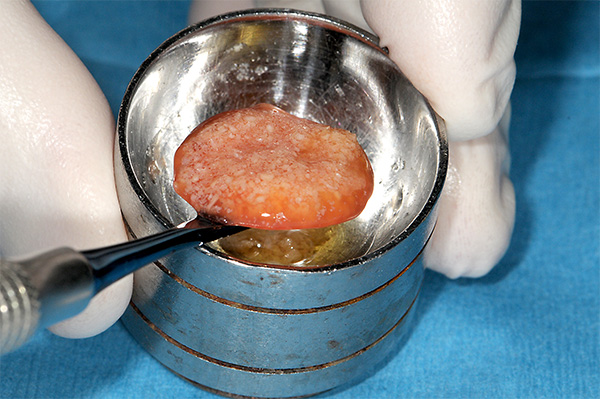
Las partículas de injerto óseo que se utilizarán son colocadas en un plato estéril (Figura 12). El líquido de plasma se extrae del tubo con una jeringa y una aguja (Figura 13), y después se coloca en el recipiente que contiene el material de injerto óseo (Figura 14). Esto hidrata las partículas de injerto seco y se deja reposar durante 10-12 minutos para unirse en una masa gelatinosa (Figura 15). Después del período de coalescencia, se forma el hueso gomoso y está listo para usarse (Figura 16). No necesita ser utilizado inmediatamente durante la cirugía y puede reposar en el recipiente hasta que la colocación del injerto en el proceso de tratamiento sea necesario.




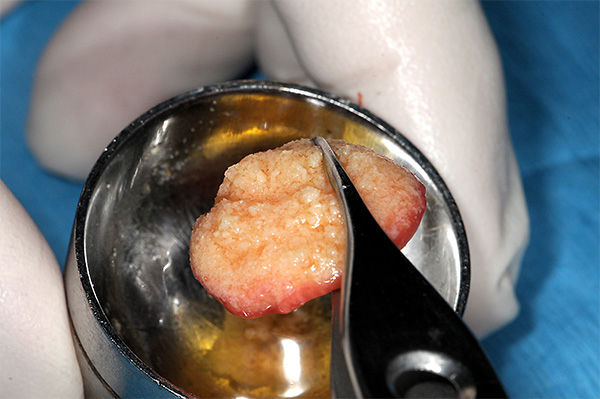
El hueso gomoso se puede usar como una sola masa (Figura 17) cuando se coloca en grandes espacios como el aumento de seno o se corta con tijeras en pedazos más pequeños (Figura 18) que se pueden colocar de manera incremental en el sitio quirúrgico. Estas piezas generalmente se adhieren entre sí cuando son colocados en contacto una con otra o con los tejidos circundantes.

Conclusión
Como se comentó, uno de los principales desafíos para el injerto óseo es el manejo de los materiales del injerto tanto durante la colocación como durante el período de cicatrización inicial. La dispersión de partículas es común con materiales en partículas como cuando son humedecidos con líquidos no hematológicos, lo cual limita el sitio de sangrado de la infusión dentro del injerto colocado inicialmente, permitiendo que ocurra la inevitable dispersión. Al colocar las partículas secas en el sitio a injertar permite que la sangre de los tejidos circundantes lo humedezca, esto también evita mantener la masa unida. Además, puede haber un sangrado limitado de la superficie de los huesos y no penetrar en todo el injerto colocado por el sangrado en el tejido blando.
La fibrina del concentrado sanguíneo autógeno tiene características más favorables que actúan como “pegamento tisular” para retener el injerto de partículas en una masa flexible. Este material flexible se maneja mejor puesto que permite una conformación más natural para el defecto estructural con el potencial de un aumento horizontal cuando sea necesario; esto no se puede lograr fácilmente con un hueso en partículas cuando no se agregan concentrados sanguíneos autógenos. Otro beneficio de las plaquetas y los factores de crecimiento es que estimulan la angiogénesis, utilizando así los factores sistémicos de los pacientes para ayudar en la fusión, organización y maduración del injerto. Los clínicos que actualmente utilizan materiales de injerto de partículas en sus modalidades de tratamiento pueden considerar la incorporación de concentrados sanguíneos autógenos como PRP para mejorar el manejo del injerto, eliminar la dispersión de partículas durante la cicatrización, y estimular la regeneración a través de los factores de crecimiento.
Referencias
- Knighton DR, Silver IA, Hunt TK.: Regulation of wound-healing angiogenesis-effect of oxygen gradients and inspired oxygen concentration. Surgery. 1981 Aug;90(2):262-70.
- Knighton DR, Hunt TK, Scheuenstuhl H, Halliday BJ, Werb Z, Banda MJ.: Oxygen tension regulates the expression of angiogenesis factor by macrophages. Science. 1983 Sep 23;221(4617):1283-5.
- Marx RE, Johnson RP.: Studies in the radiobiology of osteoradionecrosis and their clinical significance. Oral Surg Oral Med Oral Pathol. 1987 Oct;64(4):379-90.
- Hunt TK.: The physiology of wound healing. Ann Emerg Med. 1988 Dec;17(12):1265-73.
- Marx RE, Ehler WJ, Tayapongsak P, Pierce LW.: Relationship of oxygen dose to angiogenesis induction in irradiated tissue. Am J Surg. 1990 Nov;160(5):519-24.
- Knighton DR, Hunt TK, Thakral KK, Goodson WH 3rd.: Role of platelets and fibrin in the healing sequence: an in vivo study of angiogenesis and collagen synthesis. Ann Surg. 1982 Oct;196(4):379-88.
- Tayapongsak P, O'Brien DA, Monteiro CB, Arceo-Diaz LY.: Autologous fibrin adhesive in mandibular reconstruction with particulate cancellous bone and marrow. J Oral Maxillofac Surg. 1994 Feb;52(2):161-5; discussion 166.